イオン
イオンとは?
第17族は、「塩を作るもの」という意味でハロゲンと呼ばれる。それは電子をひとつ受け入れて安定な希ガス型の電子配置になって、マイナスの電気を帯びる性質がある。一方アルカリ金属やアルカリ土類金属は電子を失ってプラスの電気を持つ性質がある。電子の受取先、与え先は多くの場合水分子。

イオンができる=電解質とは
- 水(溶媒)に溶かすと、陽イオンと陰イオンに電離(解離)して電流が流れる物質のこと。
- これに対し、溶媒中に溶解しても電離しない物質を非電解質という。
- 電解質の溶液は、電圧をかけると分解することができる。→電解質
- 液体や固体の電解質も存在する。
例:
食塩(塩化ナトリウム/NaCl)は水に溶けると、ナトリウムイオンNa と塩化物イオンCl に解離して、一定の電圧以上をかけると(電極の表面で化学変化が起き)電流が流れる。
陽イオンと陰イオン
ナトリウムと塩素からは、イオンができて塩化ナトリウムができる。

周期表を丸めてみよう。すると、周期表の左右の端にあるものが結びついていることがわかる。周期表の左にある金属元素が電子を失って陽イオンになり、右にある非金属元素が電子を受け取って陰イオンになり、両者が結びついている。
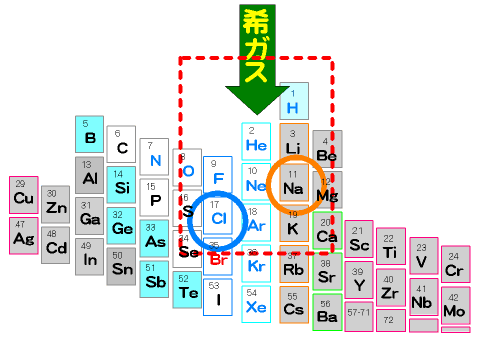
それぞれのイオンについて詳しく見てみる。
陽イオン
金属元素は、電子が外れやすく、電子が外れると電荷が現れる。

金属元素が電子を奪われて陽イオンになる。そのときに必要なエネルギーをイオン化エネルギーという。
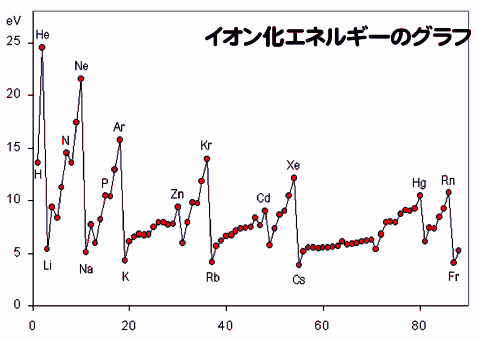
陰イオン
ハロゲンなど典型元素は電子を奪ってイオンになる。このエネルギーを電子親和力という。

イオン化エネルギーは族の性質に反映される。周期表の右上が最も大きい。

多原子イオン
NH4+やSO42+のように、複数の元素から成り立つイオン多原子イオンもある。これらは、ひとつの集団として考える。多原子イオンについては、先で改めて説明する。
陽イオンの一覧
| 族/種類 | イオン名 | イオン式 | 価数 |
|---|---|---|---|
| 1族 | 水素イオン (オキソニウム) | H+ | 1 |
| アルカリ金属 | ナトリウムイオン | Na+ | |
| カリウムイオン | K+ | ||
| 多原子イオン | アンモニウムイオン | NH4+ | |
| 2族 | マグネシウムイオン | Mg2+ | 2 |
| アルカリ土類 | カルシウムイオン | Ca2+ | |
| 12族 | 亜鉛イオン | Zn2+ | |
| 11族 | 銅(II)イオン | Cu2+ | |
| 13族 | アルミニウムイオン | Al3- | 3 |
陰イオンの一覧
| 族/種類 | イオン名 | イオン式 | 価数 |
|---|---|---|---|
| ハロゲン(17)族 | 塩化物イオン | Cl- | 1 |
| 多原子イオン | 水酸化物イオン | OH- | |
| 硝酸イオン | NO3- | ||
| 16族 | 酸化物 | O2- | 2 |
| 硫化物イオン | S2- | ||
| 多原子イオン | 硫酸イオン | SO42- | |
| 炭酸イオン | CO32- | ||
| リン酸イオン | PO43- | 3 |