色々な結合力の比較
結合力の比較は一概にはできないが、大まかに表すと
共有結合>イオン結合>金属結合>水素結合>ファンデルワールス結合
と見なしてよいが実際にはずいぶんと重なる部分が多くて、あくまで一般論として考えたほうが良い。
| \ | 結合の要因 | 結合の強さ | 代表的なもの | 導電性 | ||
|---|---|---|---|---|---|---|
| 固体のとき | 溶けると | |||||
| 共有結合 (配位結合) |
電子の共有 | 強 | 分子 | 水素分子・二酸化炭素分子・水分子 | - | |
| 固体 | ダイヤモンド・水晶 | なし | なし | |||
| イオン結合 | 静電気の引力 | やや強い | 固体 | 食塩の結晶 | なし | あり |
| 金属結合 | 電子と核 | やや弱い | 固体 | 金属 | あり | あり |
| 水素結合 | 孤立電子対と水素 | やや強 | 固体 | 氷・スクロース | なし | なし |
| ファンデルワールス力 | 電子の偏り | 弱い | 固体 | ドライアイス | なし | なし |
物質の性質を決定する化学結合
物質は、これまで学んだように色々な元素が色々な方法で結びついて作られている。その物質の多様な性質はひとえに、その物質がどのような形をして相互にどのような力で結びついているかで決定される。
物質は、ひとつ以上の元素で構成された粒子が集まっている。その物質を液体や気体、あるいは溶液としたとき--バラバラの状態でも性質を保ったまま存在できるばあい、その構成要素を分子とよぶ。希ガスは、原子ひとつひとつで存在する単原子分子。
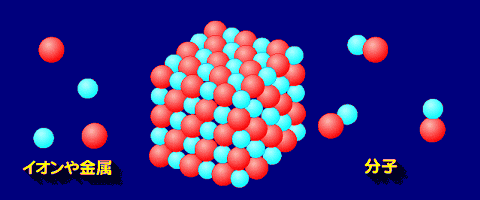
結びついている元素の種類によってどう違うか
希ガス
希ガスは、通常では他の元素と化合物をつくらず単体の単原子分子として存在する。極性もないため、結合は純粋なファンデルワールス力のみで融点も沸点もきわめて低く、常温常圧ではすべて気体である。
非金属元素の単体
共有結合で結びついた分子で、無極性なのでファンデルワールス力で結合している。そのため、結合は弱い。一般的に、原子番号が大きいほど融点・沸点が高い。

非金属元素の単体でも、炭素のように共有結合で境界なく結合している場合は、融点沸点が極めて高くもろい結晶になる。
.gif)
グラファイトは2重の共有結合が平面状に連なった構造のため(層どおしはファンデルワールス力)、性質が異なる。
非金属元素・異原子の化合物(分子)
共有結合で結びついた分子は、他の分子との間に分子間力が働く。その分子間力は分子の形、特に電気的な形によって、その集合体の性質が決まる。
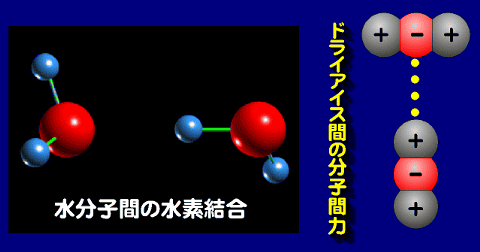
複数の非金属元素が共有結合で結びついて大きな結晶を作る場合は、非常に固くてもろい性質をもつ。

非金属元素と金属元素の化合物、および金属元素のみの固体
非金属元素と金属元素は、イオン結晶を作る場合が多い。共有結合のそれと比較すると弱いが固くてもろい結晶となる。
金属元素のみからなる固体は、金属特有の性質を示す。(前述)
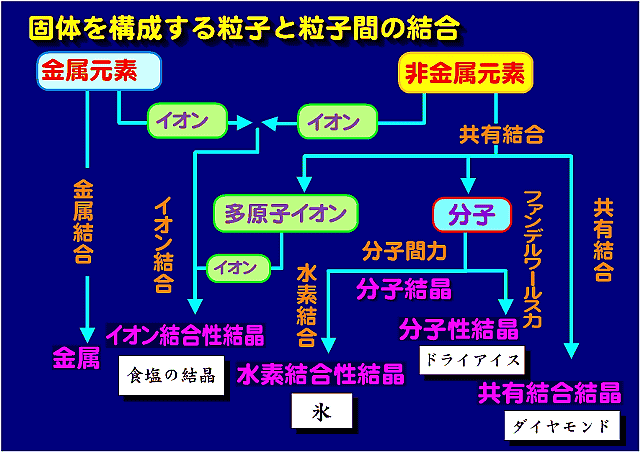
固体における化学結合
固体は、その物質を構成する粒子が化学結合によって結びつき、その位置や向きを変化させないものである。
- 共有結合による固体
- 結合に関与するもの:構成粒子の原子間で電子を共有することで結合する。
- 代表的なものと性質:ダイヤモンドや水晶に代表されるもの。結合力が強く固く(展性や延性はない)、融点が高い。電荷を担うものがないため導電性はない。
- 化学式の表し方:水晶は二酸化ケイ素の結晶で、構成する粒子間と他の粒子間の結合に差がない、というかそもそも区別できないため、全体がひとつの巨大分子と考えたほうがその化学的性質を理解しやすい。共有結合による固体は組成式で表す。
- イオン結合
- 結合に関与するもの:電子を受け渡してできるイオンの静電気力によって結合。
- 代表的なものと性質:食塩など。比較的結合力が強く、固くてもろい。
- 化学式の表し方:組成式で表す。
- 水素結合
- 結合に関与するもの:共有結合している水素原子と共有結合している陰性原子の非共有電子対との間での静電気力で結合。水素は交換される。
- 代表的なものと性質:氷の結晶。イオン結合に準じる結合力で、水の固体や液体の性質や、生体物質にとって極めて重要な働きをしている。
- 化学式の表し方:構成する粒子の分子式で表す。
- ファンデルワールス力
- 結合に関与するもの:粒子が近接したときに生じる電荷の偏りによって結合
- 代表的なものと性質:固体の酸素や窒素、ドライアイスなど。極めて弱い結合力のため、融点が極めて低い。
物質を構成する粒子間に働く化学結合や引力の違いにより物質の物理的な性質がきまる。これをまとめると図のようになる。
液体における化学結合
液体は、その位置は変わるが距離はほぼ一定に保たれている状態で厳密な意味での化学結合はない。
ただ、粒子間にはその形と極性によって、静電気力が働いている。イオン結合をする粒子においては、一般的に陽イオンと陰イオンが自由に動けるため導電性が現れる。金属の場合は原子核の格子がなくなるためだけなので導電性は保たれる。これら以外のの物質の場合は導電性は現れない。
液体になっても、固体のときに、共有結合で結びついた粒子(分子)が、共有結合以外のより弱い化学結合で結びついている場合、その分子の構造は保たれたまま液体となる。たとえば多原子イオンのイオン結晶は多原子イオンの構造は保ったままイオンとなる。
液体のときの粒子間の結合力が大きいほど沸点が高くなる。
気体
気体の場合は、基本的に粒子間には結合はない。
溶液
溶媒に粒子が溶けている場合、溶媒との親和性が良い場合、たとえば水のような極性溶媒に極性のある物質やイオンは溶けやすく。ガソリンなどの非極性溶媒には非極性粒子である油は溶けやすい。ただし、この場合も粒子の大きさと溶媒分子の大きさとか、極性物質どおしの場合の陰性度の差が近いとかの条件はある。
分子内結合
液体や気体、あるいは固体中においても共有結合で結びついてひとつの集団として他と区別できる場合がある。