共有結合と価電子
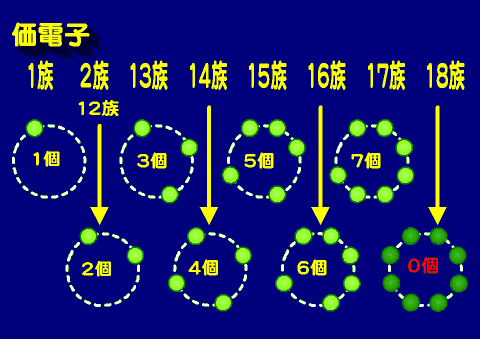
周期表の希ガス(18族)を基本にして左によるほど、価電子の数は8から一つずつ少ない。
非金属元素のみについて考えること!!

共有結合に使われる価電子は?
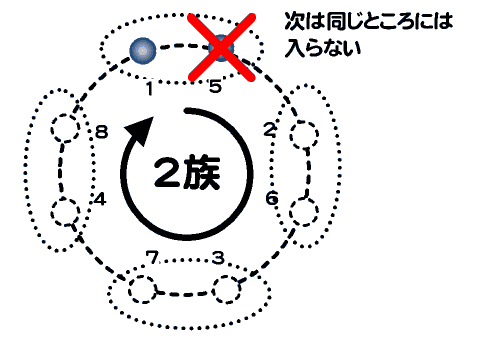
1族から順番に見ると、K殻以降の電子は2個ずつのペアで考えると理解しやすい。ひとつのペアに電子がすでに一つ入っている場合、次の電子はそこではなく次のペアの空席を埋める形で入っていく。
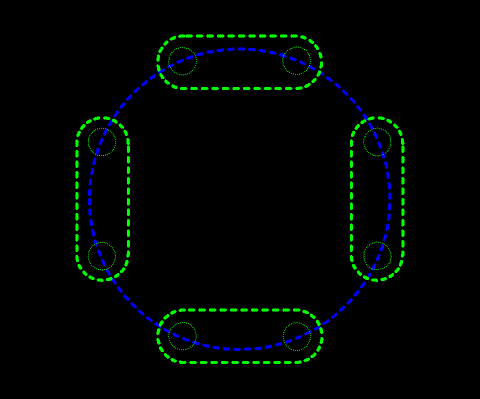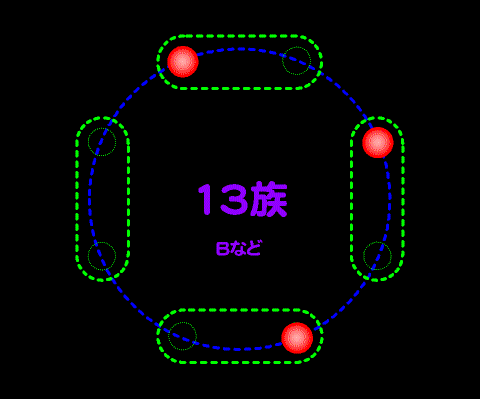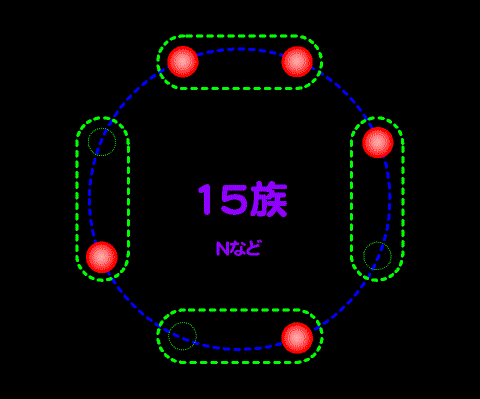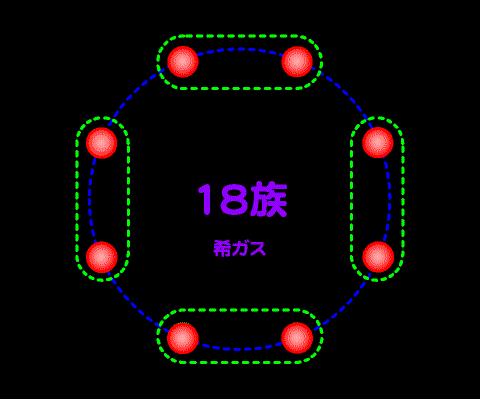
これは典型元素が、量子力学で言うところのs軌道とp軌道の電子が最も外側にあることに由来する。よって、遷移元素はこの法則に当てはまらない。遷移元素・内殻については扱わない。
興味があるなら、遷移元素 - Wikipediaなどを読むこと。
非金属元素の価電子
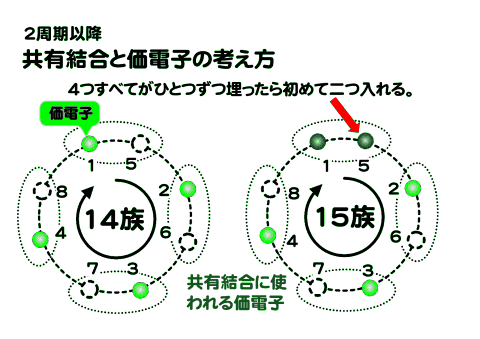
14族から17族について見ると14族で4つの価電子が存在して4つのペア席はひとつずつ埋まっているため、15族になって初めて電子はペアになる。・・電車に乗って席を探して座るようなもの・・・

価電子の増え方
2周期以降は、最外殻電子の数は8個なので1族から電子が一個ずつ増えていく。1族、2族には2周期以降非金属元素はないので共有結合には関与しないが・・。

これが14族になると、すべての二人がけの席は埋まるため、次の15族ではじめて二人掛け席が埋まり始める。
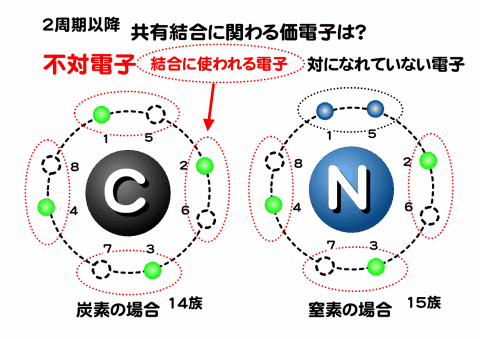
非金属元素(炭素・窒素)と不対電子
14族の炭素と15族の窒素を見ると、ペアになっていない電子が炭素では4個、窒素では3個ある。このようにペアになっていない電子を不対電子と呼ぶ。ペアになっているほうは対電子。
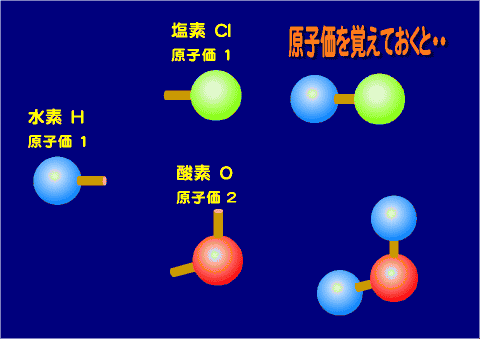
原子価
この化学結合に関わる電子を原子価と呼ぶ

原子価(げんしか)とはある原子が何個の他の原子と結合するかを表す数となる。いわゆる結合する「"手"の数」と考えると良い。
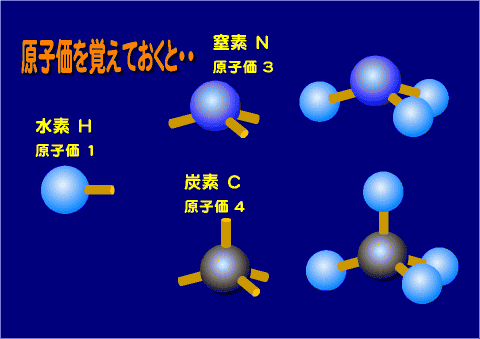
(元素によっては複数の原子価を持つものもあり、特に遷移金属は多くの原子価を取ることができる。)
定比例の法則の確立によってある化合物に含まれる元素の質量の比は恒に一定であることが示された。ジョン・ドルトンはこれを説明するために原子の概念を導入し、ある化合物に含まれる各元素の原子の数の比は恒に一定となるという考えを示した。この考えに基づいて様々な化合物の組成式を調べていくとその組成に法則性があることが分かってきた。例えばある金属原子に酸素原子が結合する場合、その数は塩素原子が結合する数の半分となる。 そこで水素原子や塩素原子を基準として、これら何個と結合できるかという数として原子価の概念が導入された。
希ガスの原子の最外殻電子の数が8個であることから、ワルター・コッセルは希ガスと同じ電子配置が安定であるため、原子はそのような電子配置を持つイオンを生じやすいと提唱した。また、ギルバート・ルイスとアーヴィング・ラングミュアは原子核を中心とする立方体の8つの頂点に最外殻電子が位置し、この頂点がすべて埋まった場合に原子が安定になるというオクテット説を提唱した。そしてそのようになるために他の原子と電子を共有して共有結合が生じると説明した。この時にはなぜ最外殻電子の数が8個となると安定なのかは不明なままであったが、これは量子力学により電子配置の詳細が研究されて明らかとなった。
原子価(Valence)は、それぞれの原子が他の原子と結びつくときに何本の手を持っているかを示す指数としてイメージできる。一方、(原子)価電子(Valence Electron)は、最外殻にある電子の個数である。

この原子価と、族と価電子の関係との関連をしっかり理解しておこう。
窒素の場合
窒素の場合について詳しく見ると、不対電子は3個、対電子は2個の合わせて5個の価電子がある。

その他の非金属元素と不対電子
他の16族、17族についても同じように考えてみよう