電気陰性度
これで分子の形はわかるようになったけど、もうひとつ物質の性質を説明するために必要な知識がある。それが物質相互を結びつける力である電気的な性質である。
分子の電気的な性質は分子を構成している原子の電気的な性質によって予測できる。
イオン結合のところで見たように、元素によって電子をひきつける力は強弱があるため、異なる元素間で結合している場合には、一般的に電子はどちらに偏っている。この電子の偏り方を示す度合いを電気陰性度という。
電気陰性度は、イオンのときに学んだイオン化エネルギーと、電子親和力をひとつにしたものである。電荷の偏りがある場合、その分子には電気的な偏りによる極性があらわれる。
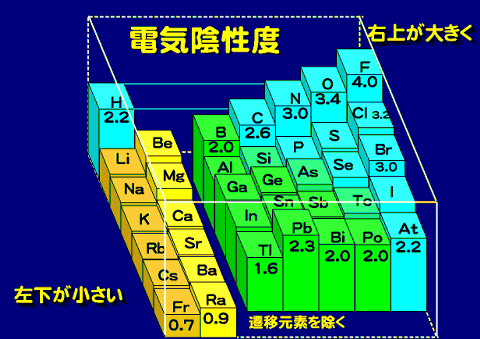
今まで登場した化合物についてその形と極性を見てみよう。この形と極性はその物質の性質を決める重要な要素となる。

水の構造
もっとも身近な水について見てみよう。水は不対電子を2個持つ酸素と不対電子を1個持つ水素原子2個が共有結合したものだ。
この結合は非常に強い。そのため、気体や液体中でもこの結合は切り離されず分子として存在することができる。言い換えると分子は共有結合によってのみ形成される(単原子分子は除く)。
共有結合のまとめ
共有結合とは、それぞれの原子が電子を共有することで結びついていて、極めて強い結合であり、気体や液体状態になってもその結合はたもたれることが多い。それを分子という。
こうしてできた分子が、異なる原子間の共有結合によるものである場合、電気陰性度の差によって結合間の電子は偏っている。それがその形状によっては、極性として現れる。
この分子の形と極性によって分子間は分子間力で結びつき、またその物質の性質をきめる。
なお、結晶そのものが共有結合で結びついたものがある。後で説明する。