酢酸ナトリウムの溶解と熱
酢酸ナトリウムを溶かしたり、凝結させて熱の変化を観察する。
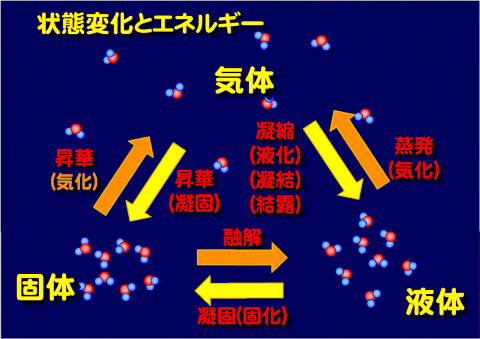
物資の三態と状態変化
多くの純物質は温度や圧力を変化させた場合、固体、液体、気体の3つの状態をとる。これらそれぞれの状態に対応する相を固相、液相、気相という。(プラズマと呼ばれる状態を含めない)それぞれの状態とはどんなもので、それらの間での変化の仕方とエネルギーについて学ぶ。
プラズマ (plasma) は、正の電荷をもつ粒子(イオン)と負の電荷をもつ電子が電離状態で同程度分布し、全体としてほぼ電気的中性を保つ粒子集団のこと。1928年にアーヴィング・ラングミュアによって命名された。固体、液体、気体に続く、物質の第4形態といわれている。
プラズマ - Wikipedia
固体・液体・気体の違い
物質の3つの状態について詳しく見てみる。
固体
固相
物質を構成するイオン、原子、分子などの構成粒子が密に詰まっている状態。
粒子間に働く力が十分強く、粒子は振動する以外は自由に動けない。その結果、固体は安定で、定まった形と体積を持つ。微視的に見れば、物質を構成する粒子がその平均位置をほとんど変えない状態である。
固体が力によって形を変える時には、壊れたり切れたりする。すなわち、一定の剛性や弾性を持ち、体積圧縮率は小さい。
粒子が一定の三次元構造をとって配列している場合を結晶という。結晶構造をとらない固体(アモルフォス・ガラス)も存在する。
液体
液相
構成する粒子が自由に動き回って位置を変えられるが,粒子間の引力は働いているため、圧力で体積は大きく変化しない。このような状態を物質が液相であるという。温度と圧力が一定なら、体積は一定である
物質を構成する原子や分子の相対位置は自由に変化できるが、原子や分子の間の距離はほとんど変化できない状態である。剛性率は零だが体積圧縮率は固体と同程度に小さい。体積は通常は固体状態よりも大きい。
水は、融点の近くでは液体よりも固体の方が体積が大きい極めて特異な物質である。これは、水の分子間に働く分子間力が極めて強く、かつ方向性があるためである。水素結合
参考サイト地球上の生命を育む水のすばらしさの更なる認識と新たな発見を目指して 報告書-第1章
気体
気相
気体中の粒子(分子)は高いエネルギーを持ち、分子間力の影響はほとんど無い(理想気体では零)。分子はそれぞれ遠く離れて高速で移動している。
気体は定まった形や体積を持たず、容器に応じて変わる。容器や圧力がなければ無限に膨張できる。
(臨界温度以下の温度では、)気体は蒸気とも呼ばれ、温度を下げずに圧力をかけると液体になる。気体の圧力が液体(又は固体)の蒸気圧と等しくなる時には、蒸気は液体(又は固体)と平衡状態を保って存在する。
その他の状態
プラズマと呼ばれる、電子とイオンに分離した状態もあり、物質の第4の状態とも呼ばれる。
状態変化
多くの(比較的構造の簡単な)物質は固体・液体・気体の三態をとる。それは、物質を構成する粒子は、お互いにひきつけあっているが、同時にその置かれた温度によって絶えず熱運動をしている。この引力と熱運動の激しさの関連で、
- 構成粒子がその位置をほとんど変えない(変えられない)固体
- 位置は自由に変えられるが距離が変わらない液体
- 距離も位置も自由に変えられる気体
のいずれかの状態になるからである。このそれぞれの状態を相という、それぞれ固相、液相、気相とよび、その間の変化を物質の相変化、あるいは物質の状態変化という。
| 転移前の相 | 転移後の相 | 現象の呼称 |
|---|---|---|
| 固相 (固体) | 液相 | 融解 |
| 気相 | 昇華 気化 | |
| 液相 (液体) | 固相 (固体) | 凝固 固化 |
| 気相 (気体) | 蒸発 気化 | |
| 気相 (気体) | 液相 (液体) | 凝縮 液化 |
| 固相 (固体) | 凝結 |
(状態変化とエネルギー)
物質がその状態を変化させるときは、エネルギーの出入りを伴う。


(沸点)
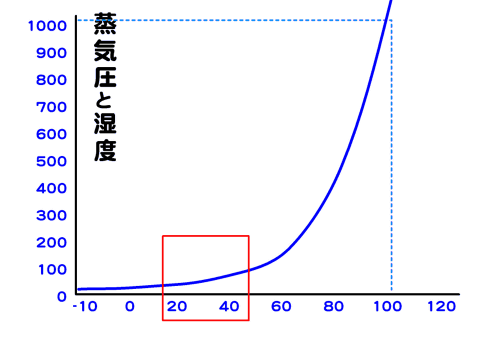
その物質の蒸気圧と、液体の圧力が等しくなる温度で、沸点ではその物質の気体と液体が共存できる。
水の場合、1気圧(1.013×105Pa)では水の蒸気圧が1気圧(1.013×105Pa)となり、内部からも蒸発(気化)が起きうる。
蒸気圧
任意の温度に対して、その物質の気体が液体状態あるいは固体状態と平衡になる圧を、その物質のその温度での蒸気圧と呼ぶ。
その物質の分圧が液体の蒸気圧に等しいとき、その液体は気液平衡の状態にある。
沸点
ある物質の臨界点以下の圧力と液体の飽和蒸気圧が等しくなる温度のことで、沸騰点ともいう。特に1atmのときの沸点を標準沸点という。
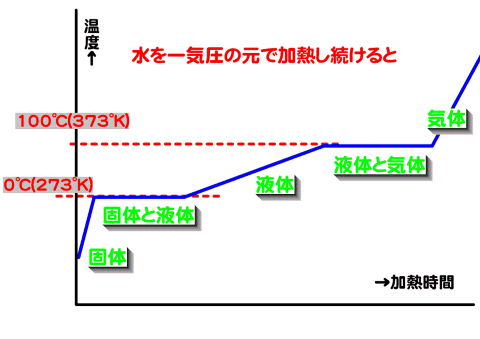
状態変化と熱エネルギーの関係を考えてみよう。
洗濯物は沸点以下でも乾燥するのはなぜか?
氷がとけるときに熱を吸収する。・・・・氷を溶かすためには熱を加えなければならない。
皮膚や衣類がぬれると体温が下がる。特に風が強いときは・・・
熱を伝える方法・・・蓄える方法
(融点・凝固点)
固体と液体が共存する温度で、圧力が決まれば物質によって一定の値をとる。
沸点は圧力が上がれば高くなる。融点(凝固点)は液体の密度と固体の密度の違いにより高くなったり低くなったりする。
なお、実際に沸騰や融解・凝固が始まる温度はずれる。
(注意)
蒸発と沸騰は異なる。水は100℃(1.013×105Pa)で沸騰するが、それ以下の温度でも蒸発(気化)は起きる。
それぞれの状態が代わることを状態変化という。
- 固体から液体への変化 融解 - 物性値:融点、凝固点
- 固体から気体への変化 昇華・気化
- 液体から固体への変化 凝固・固化
- 液体から気体への変化 蒸発・気化 - 物性値:沸点
- 気体から固体への変化 凝固・昇華
- 気体から液体への変化 凝縮・液化・凝結・結露
| 転移前の相 | 転移後の相 | 現象の呼称 | 転移点の呼称 | 転移熱の呼称 |
|---|---|---|---|---|
| 固相 (固体) | 液相 | 融解 | 融点 | 融解熱 |
| 気相 | 昇華 気化 | 昇華点 | 昇華熱 | |
| 液相 (液体) | 固相 (固体) | 凝固 固化 | 凝固点 | 凝固熱 |
| 気相 (気体) | 蒸発 気化 | 沸点 | 蒸発熱 気化熱とも呼ぶ。 | |
| 気相 (気体) | 液相 (液体) | 凝縮 液化 | (特になし) | 凝縮熱 |
| 固相 (固体) | 凝結 | (特になし) | (特になし) |
状態変化に伴う熱の出入
なお、状態変化には必ず熱(エネルギー)の出入りをともなう。